Tumorwachstum bei Krebspatienten durch Stress
Jüngste Studien haben eine Schlüsselrolle des sympathischen Nervensystems (SNS) sowie von adrenergem Stress bei der Vermittlung der Immunsuppression im Zusammenhang mit chronischen Entzündungen bei Krebs und anderen Krankheiten aufgezeigt. Der Zusammenhang zwischen chronischer Aktivierung des sympathischen Nervensystems, adrenergem Stress und Immunsuppression hängt zum Teil mit der Fähigkeit von Katecholaminen zusammen, die Freisetzung und Differenzierung von aus dem Knochenmark stammenden (myeloischen) Suppressorzellen (MDSC) im Knochenmark zu stimulieren.
Im Normalfall regulieren diese Suppressor- (Unterdrückungs-) Zellen die Erneuerung des Gewebes und die Immunantwort. Im Falle von lang anhaltenden Krankheiten (eben zum Beispiel Krebs) reichern sich MDSC im Körper an und haben meist einen negativen Effekt auf die Heilung. Und das ist von Bedeutung für die Behandlung von Hunden.
Zahlreiche Studien haben gezeigt, dass der β-adrenerge Rezeptor (diese Rezeptoren werden insbesondere durch Adrenalin aktiviert) eine wichtige Rolle bei der Unterdrückung der Krebsimmunität spielt, wenn Tiere einem chronischen Stress ausgesetzt sind.
Wichtig ist, dass eine therapeutische Blockade der beta-adrenergen Reaktionen durch Medikamente wie Propranolol die Bildung und Differenzierung von myeolischen Suprressorzellen (MDSC) teilweise rückgängig machen und die Tumorimmunität teilweise wiederherstellen kann. Klinische Studien an krebskranken Menschen und Hunden haben gezeigt, dass eine Propranolol-Blockade das Ansprechen auf Strahlentherapie, Krebsimpfstoffe und Immun-Checkpoint-Inhibitoren verbessern kann. Damit ist die SNS-Stressreaktion zu einem wichtigen neuen Ziel geworden, um die Immunsuppression bei Krebs und anderen chronischen Entzündungen zu lindern.
Folgende Grafiken zeigen die Regelkreise deutlich:
Grafik 1:
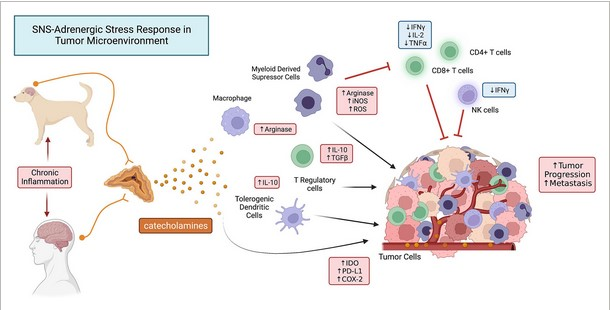
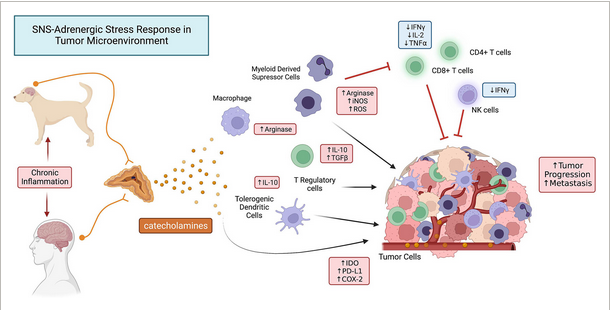
Immunsuppressionswege, die durch SNS-adrenerge Stressreaktionen bei Krebs aktiviert werden. Krebsbedingte chronische Entzündungen aktivieren Wege im Gehirn, die letztlich die Freisetzung von Katecholaminen aus dem Nebennierenmark auslösen. Diese zirkulierenden Katecholamine (vor allem Noradrenalin und Epinephrin) binden an β-AR-Rezeptoren, die auf Immunzellen, einschließlich Makrophagen, myeloiden Suppressorzellen (MDSC), Dendritische Zellen und Tregs, weit verbreitet sind. Die Signalübertragung durch diese adrenergen Signalwege übt mehrere immunsuppressive Wirkungen aus, einschließlich der Mobilisierung von MDSC im Knochenmark und der Hochregulierung immunsuppressiver Signalwege, einschließlich der Freisetzung immunsuppressiver Zytokine (IL-10, TGF-b), der hochregulierten Expression von inhibitorischen Checkpoint-Molekülen (PD-1, PD-L1) und der Überexpression immunsuppressiver Stoffwechselwege (IDO, COX2). Der Nettoeffekt dieser anhaltenden adrenergen Aktivierung ist sowohl eine systemische Immunsuppression als auch eine lokale Tumorimmunsuppression, was zu einem beschleunigten Tumorwachstum und zur Metastasierung führt.
Grafik 2 zeigt den Wirkungspunkt des Propranolol
Mobilisierung von myeloiden Suppressorzellen (MDSC) als Reaktion auf adrenerge Stresswege und Hemmung durch den Betablocker Propranolol. Die Aktivierung von β-ARs durch Katecholamine, die als Reaktion auf krebsbedingte Entzündungen freigesetzt werden, führt zu einer erhöhten Produktion von Wachstumsfaktoren und Zytokinen (IL-3, GM-CSF, G-CSF) im Knochenmark, die sowohl M-MDSC als auch PMC-MDSC aus dem Knochenmark in den Blutkreislauf mobilisieren. Nach ihrer Mobilisierung werden diese zirkulierenden MDSC durch Chemokine wie CCL2, CCL3, CCL4 und CXCL8 in Tumorgewebe und sekundäre lymphoide Organe rekrutiert. In diesen Geweben unterdrücken die MDSC Immunantworten, indem sie immunsuppressive Zytokine (IL-10, TGF-β) bilden und die Proliferation und Funktion von T-Effektorzellen unterdrücken, was zu einer systemischen und lokalen Unterdrückung des Krebsimmunsystems führt. Die durch adrenergen Stress vermittelte Mobilisierung von MDSC kann durch den Betablocker Propranolol blockiert werden, und darüber hinaus können die immunsuppressiven Funktionswege, die von MDSC in Geweben genutzt werden, durch Induktion der MDSC-Differenzierung unterbrochen werden.
Wichtige Forschungsansätze zur Wirkung von Propranolol
Obwohl die meisten Forschungsarbeiten zu MDSCs nach wie vor an Menschen und Mäusen durchgeführt werden, haben neuere Arbeiten interessante Erkenntnisse bei Hunden aufgezeigt. So wurde beispielsweise festgestellt, dass die MDSC-Konzentration bei Hunden positiv mit der Last an Mammatumor korreliert. Dies deutet darauf hin, dass die MDSC-Konzentration als Biomarker zur Identifizierung von Patienten mit fortgeschrittenem Krankheitsverlauf und Metastasierung verwendet werden könnte. Auch bei Hunden mit Melanom war die zirkulierende Anzahl von MDSC erhöht. Hier können sich auch Hinweise für Behandlungsmöglichkeiten ergeben.
In mehreren Studien wurde der Einsatz von Propranolol als neuartiges Mittel zur Behandlung von Krebs bei Hunden untersucht. Die meisten bisherigen Studien konzentrierten sich auf die antiangiogenen Eigenschaften von Propranolol zur Behandlung eines aggressiven Krebses bei Hunden, des Hämangiosarkoms. In vitro übt Propranolol eine signifikante antiangiogene Aktivität sowohl gegen nicht transformierte Endothelzellen als auch gegen Zellen des Hämangiosarkom aus. Was den Einsatz von Propranolol als immunmodulierendes Medikament betrifft, so wurde vor kurzem berichtet, dass die Behandlung von Hunden mit Hirntumoren mit Propranolol (plus Losartan) und einem Tumorimpfstoff zu einer objektiven Tumoransprechrate von 20 % ohne zusätzliche Behandlung sowie zu einer biologischen Gesamtansprechrate von 60 % führte. Es gibt also klinische Belege dafür, dass die Propranolol-Immuntherapie bei Hunden mit aggressiven Krebserkrankungen klinische Vorteile bringen kann und auch als wirksames Impfstoffadjuvans bei Hunden fungieren kann.
Quelle:
Ammons DT et al (2023): Chronic adrenergic stress and generation of myeloid-derived suppressor cells: Implications for cancer immunotherapy in dogs, https://doi.org/10.1111/vco.12891

